En los dos post anteriores de este blog he descrito las generalidades de las baterías recargables y cómo son las más ampliamente utilizadas en la actualidad, las baterías de iones de litio. En este texto prosigo con la descripción de esta clase de baterías para analizar los procesos de carga y descarga de las mismas, que son la clave de su funcionamiento.
1. Cómo se carga y descarga una batería de ion-litio.
En las baterías de ion-litio, los iones se mueven en una dirección cuando la batería se carga, es decir, cuando absorbe energía que le proporciona una fuente externa y se mueven en sentido contrario cuando la batería se descarga, que es el momento en el que la batería está suministrando energía a una determinada carga. El proceso se muestra en la imagen:
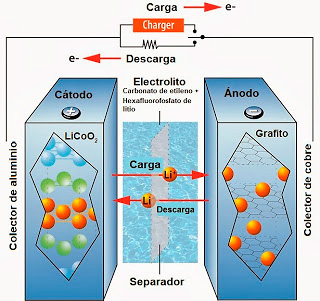
1.1 Proceso de carga
Durante la carga, que se realiza conectando la batería a una fuente de energía externa (la red eléctrica, por ejemplo), algunos iones de litio abandonan el electrodo positivo (el cátodo), que habitualmente es de óxido de cobalto y litio (LiCoO3), y fluyen hacia el electrodo negativo (el ánodo, generalmente de grafito) a través del electrolito (mostrado en el centro de la imagen en color azulado). Los electrones también fluyen desde el electrodo positivo al negativo, pero lo hacen a través del circuito externo. Cuando los iones de litio llegan al grafito, se insertan entre las capas atómicas de ese material, donde se recombinan con los electrones, quedando el litio depositado allí.
Cuando ya no fluyan más iones, la batería está completamente cargada y lista para usar. En este estado de carga, los iones de litio se almacenan entre las diferentes capas de carbono del electrodo de grafito, de manera que en su estado de carga, el ánodo es efectivamente una especie de “bocadillo” integrado por capas de carbono que se alternan con las capas de iones de litio.
En este proceso, la batería almacena energía, dado que el potencial electroquímico del grafito es más elevado que el del óxido de cobalto y litio y, por consiguiente, los iones de litio tienen que “subir”, desde el potencial al que se encuentran en el cátodo, hasta el del ánodo.
1.2 Proceso de descarga
Durante la descarga, los iones fluyen de regreso a través del electrolito desde el ánodo de grafito hacia al cátodo de óxido de cobalto y litio. Los electrones también fluyen desde el ánodo al cátodo, pero lo hacen a través del circuito exterior, alimentando un ordenador portátil, un teléfono móvil, un vehículo, etc. Esto es así dado que los iones de litio en el grafito están a un potencial electroquímico más alto del que tenían en el óxido de cobalto y litio, como ya se ha visto en el párrafo anterior, y por lo tanto “bajan” su potencial electroquímico, razón por la que ahora aportan energía al circuito al que se conecten.
Ese exceso de energía es el que ceden al circuito exterior, razón por la que cualquier dispositivo que esté conectado a la batería puede realizar su función. Cuando todos los iones de litio se han desplazado de vuelta al electrodo de óxido de cobalto y litio, la batería está completamente descargada.
Es decir, en los procesos de carga y descarga de la batería, los iones de litio se desplazan de un electrodo a otro. En ambos casos, los electrones fluyen en dirección opuesta a los iones a través del circuito externo. Los electrones no fluyen a través del electrolito, ya que este es una barrera aislante muy efectiva que impide la circulación de los electrones a través de él.
Durante el proceso de descarga, se genera una tensión entre los electrodos bastante alta, del orden de 3,5-4 voltios, que es lo que produce cada pila, debida a la diferencia de potenciales electroquímicos existente entre ánodo y cátodo ya indicada. Este valor es mucho más alto que los 1,5 voltios típicos de una pila alcalina AA normal y ayuda a que las baterías de iones de litio sean más compactas, lo que facilita su uso en dispositivos pequeños como los teléfonos móviles.
En el próximo post de esta serie, detallaré los pros y contras de estas baterías de litio.








Muchas gracias por la nota que me parece muy clara y útil. Sin embargo hay algo que no entiendo y no sé si es un error. En el texto se dice:
“…en los procesos de carga y descarga de la batería, los iones de litio se desplazan de un electrodo a otro. En ambos casos, los electrones fluyen en dirección opuesta a los iones a través del circuito externo.”
Pero por lo que pone en la explicación, yo entiendo que el flujo de electrones no es en sentido contrario al de los iones, por lo que esa frase final me deja dudosa.
Muchas gracias
Interesante, seguiré leyendo, gracias